Calor específico
El calor específico es una magnitud física como la cantidad de calor que hay que suministrar a la unidad de masa de una sustancia o sistema termodinámico para elevar su temperatura en una unidad (kelvin o grado Celsius). En general, el valor del calor específico depende de dicha temperatura inicial. Se le representa con la letra (minúscula).
De forma análoga, se define la capacidad calorífica como la cantidad de calor que hay que suministrar a toda la masa de una sustancia para elevar su temperatura en una unidad (kelvin o grado Celsius). Se la representa con la
Por lo tanto, el calor específico es el cociente entre la capacidad calorífica y la masa, esto es donde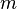 es la masa de la sustancia
es la masa de la sustancia
Cuanto mayor es el calor específico de las sustancias, más energía calorífica se necesita para incrementar la temperatura. Por ejemplo, se requiere ocho veces más energía para incrementar la temperatura de un lingote de magnesio que para un lingote de plomo de la misma masa.[nota 1]
El término "calor específico" tiene su origen en el trabajo del físico Joseph Black, quien realizó variadas medidas calorimétricas y usó la frase “capacidad para el calor”.[4] En esa época la mecánica y la termodinámica se consideraban ciencias independientes, por lo que actualmente el término podría parecer inapropiado; tal vez un mejor nombre podría ser transferencia de energía calorífica específica, pero el término está demasiado arraigado para ser reemplazado.[5]
 ) correspondiente a un cierto intervalo de temperaturas
) correspondiente a un cierto intervalo de temperaturas 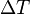 se define en la forma:
se define en la forma:
donde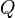 es la transferencia de energía en forma calorífica entre el sistema y su entorno u otro sistema,
es la transferencia de energía en forma calorífica entre el sistema y su entorno u otro sistema,  es la masa del sistema (se usa una n cuando se trata del calor específico molar) y
es la masa del sistema (se usa una n cuando se trata del calor específico molar) y 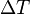 es el incremento de temperatura que experimenta el sistema. El calor específico (
es el incremento de temperatura que experimenta el sistema. El calor específico ( ) correspondiente a una temperatura dada
) correspondiente a una temperatura dada 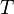 se define como:
se define como:
El calor específico ( ) es una función de la temperatura del sistema; esto es,
) es una función de la temperatura del sistema; esto es,  . Esta función es creciente para la mayoría de las sustancias (excepto para los gases monoatómicos y diatómicos). Esto se debe a efectos cuánticos que hacen que los modos de vibración estén cuantizados y sólo estén accesibles a medida que aumenta la temperatura. Conocida la función
. Esta función es creciente para la mayoría de las sustancias (excepto para los gases monoatómicos y diatómicos). Esto se debe a efectos cuánticos que hacen que los modos de vibración estén cuantizados y sólo estén accesibles a medida que aumenta la temperatura. Conocida la función  , la cantidad de calor asociada con un cambio de temperatura del sistema desde la temperatura inicial
, la cantidad de calor asociada con un cambio de temperatura del sistema desde la temperatura inicial  a la final
a la final  se calcula mediante la integral siguiente:
se calcula mediante la integral siguiente:
En un intervalo donde la capacidad calorífica sea aproximadamente constante la fórmula anterior puede escribirse simplemente como:
 . El calor específico de los gases normalmente se mide bajo condiciones de presión constante (Símbolo:
. El calor específico de los gases normalmente se mide bajo condiciones de presión constante (Símbolo:  ). Las mediciones a presión constante producen valores mayores que aquellas que se realizan a volumen constante (
). Las mediciones a presión constante producen valores mayores que aquellas que se realizan a volumen constante ( ), debido a que en el primer caso se realiza un trabajo de expansión.
), debido a que en el primer caso se realiza un trabajo de expansión.
El cociente entre los calores específicos a presión constante y a volumen constante para una misma sustancia o sistema termodinámico se denomina coeficiente adiabático y se designa mediante la letra griega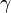 (gamma).[7] Este parámetro aparece en fórmulas físicas, como por ejemplo la de la velocidad del sonido en un gas ideal.
(gamma).[7] Este parámetro aparece en fórmulas físicas, como por ejemplo la de la velocidad del sonido en un gas ideal.
El calor específico de las sustancias distintas de los gases monoatómicos no está dado por constantes fijas y puede variar un poco dependiendo de la temperatura.[nota 2] Por lo tanto, debe especificarse con precisión la temperatura a la cual se hace la medición. Así, por ejemplo, el calor específico del agua exhibe un valor mínimo de 0,99795 cal/(g·K) para la temperatura de 34,5 °C, en tanto que vale 1,00738 cal/(g·K) a 0 °C. Por consiguiente, el calor específico del agua varía menos del 1% respecto de su valor de 1 cal/(g·K) a 15 °C, por lo que a menudo se le considera como constante.
La presión a la que se mide el calor específico es especialmente importante para gases y líquidos.
En los Estados Unidos, y en otros pocos países donde se sigue utilizando el Sistema Anglosajón de Unidades, en aplicaciones no científicas, el calor específico se suele medir en BTU (unidad de calor) por libra (unidad de masa) y grado Fahrenheit (unidad de temperatura).
La BTU se define como la cantidad de calor que se requiere para elevar un grado Fahrenheit la temperatura de una libra de agua en condiciones atmosféricas normales.[
De forma análoga, se define la capacidad calorífica como la cantidad de calor que hay que suministrar a toda la masa de una sustancia para elevar su temperatura en una unidad (kelvin o grado Celsius). Se la representa con la
Por lo tanto, el calor específico es el cociente entre la capacidad calorífica y la masa, esto es donde
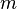 es la masa de la sustancia
es la masa de la sustanciaIntroducción
El calor específico es una propiedad intensiva de la materia, por lo que es representativo de cada materia; por el contrario, la capacidad calorífica es una propiedad extensiva representativa de cada cuerpo o sistema particular.[3] (Ver tabla en: Calor específico y capacidad calorífica de algunos materiales.)Cuanto mayor es el calor específico de las sustancias, más energía calorífica se necesita para incrementar la temperatura. Por ejemplo, se requiere ocho veces más energía para incrementar la temperatura de un lingote de magnesio que para un lingote de plomo de la misma masa.[nota 1]
El término "calor específico" tiene su origen en el trabajo del físico Joseph Black, quien realizó variadas medidas calorimétricas y usó la frase “capacidad para el calor”.[4] En esa época la mecánica y la termodinámica se consideraban ciencias independientes, por lo que actualmente el término podría parecer inapropiado; tal vez un mejor nombre podría ser transferencia de energía calorífica específica, pero el término está demasiado arraigado para ser reemplazado.[5]
[editar] Ecuaciones básicas
El calor específico medio ( ) correspondiente a un cierto intervalo de temperaturas
) correspondiente a un cierto intervalo de temperaturas 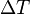 se define en la forma:
se define en la forma:donde
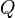 es la transferencia de energía en forma calorífica entre el sistema y su entorno u otro sistema,
es la transferencia de energía en forma calorífica entre el sistema y su entorno u otro sistema,  es la masa del sistema (se usa una n cuando se trata del calor específico molar) y
es la masa del sistema (se usa una n cuando se trata del calor específico molar) y 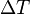 es el incremento de temperatura que experimenta el sistema. El calor específico (
es el incremento de temperatura que experimenta el sistema. El calor específico ( ) correspondiente a una temperatura dada
) correspondiente a una temperatura dada 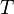 se define como:
se define como:El calor específico (
 ) es una función de la temperatura del sistema; esto es,
) es una función de la temperatura del sistema; esto es,  . Esta función es creciente para la mayoría de las sustancias (excepto para los gases monoatómicos y diatómicos). Esto se debe a efectos cuánticos que hacen que los modos de vibración estén cuantizados y sólo estén accesibles a medida que aumenta la temperatura. Conocida la función
. Esta función es creciente para la mayoría de las sustancias (excepto para los gases monoatómicos y diatómicos). Esto se debe a efectos cuánticos que hacen que los modos de vibración estén cuantizados y sólo estén accesibles a medida que aumenta la temperatura. Conocida la función  , la cantidad de calor asociada con un cambio de temperatura del sistema desde la temperatura inicial
, la cantidad de calor asociada con un cambio de temperatura del sistema desde la temperatura inicial  a la final
a la final  se calcula mediante la integral siguiente:
se calcula mediante la integral siguiente:En un intervalo donde la capacidad calorífica sea aproximadamente constante la fórmula anterior puede escribirse simplemente como:
Cantidad de sustancia
Cuando se mide el calor específico en ciencia e ingeniería, la cantidad de sustancia es a menudo de masa, ya sea en gramos o en kilogramos, ambos del SI. Especialmente en química, sin embargo, conviene que la unidad de la cantidad de sustancia sea el mol al medir el calor específico, el cual es un cierto número de moléculas o átomos de la sustancia.[6] Cuando la unidad de la cantidad de sustancia es el mol, el término calor específico molar se puede usar para referirse de manera explícita a la medida; o bien usar el término calor específico másico, para indicar que se usa una unidad de masa.[editar] Conceptos relacionados
Hay dos condiciones notablemente distintas bajo las que se mide el calor específico y éstas se denotan con sufijos en la letra . El calor específico de los gases normalmente se mide bajo condiciones de presión constante (Símbolo:
. El calor específico de los gases normalmente se mide bajo condiciones de presión constante (Símbolo:  ). Las mediciones a presión constante producen valores mayores que aquellas que se realizan a volumen constante (
). Las mediciones a presión constante producen valores mayores que aquellas que se realizan a volumen constante ( ), debido a que en el primer caso se realiza un trabajo de expansión.
), debido a que en el primer caso se realiza un trabajo de expansión.El cociente entre los calores específicos a presión constante y a volumen constante para una misma sustancia o sistema termodinámico se denomina coeficiente adiabático y se designa mediante la letra griega
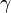 (gamma).[7] Este parámetro aparece en fórmulas físicas, como por ejemplo la de la velocidad del sonido en un gas ideal.
(gamma).[7] Este parámetro aparece en fórmulas físicas, como por ejemplo la de la velocidad del sonido en un gas ideal.El calor específico de las sustancias distintas de los gases monoatómicos no está dado por constantes fijas y puede variar un poco dependiendo de la temperatura.[nota 2] Por lo tanto, debe especificarse con precisión la temperatura a la cual se hace la medición. Así, por ejemplo, el calor específico del agua exhibe un valor mínimo de 0,99795 cal/(g·K) para la temperatura de 34,5 °C, en tanto que vale 1,00738 cal/(g·K) a 0 °C. Por consiguiente, el calor específico del agua varía menos del 1% respecto de su valor de 1 cal/(g·K) a 15 °C, por lo que a menudo se le considera como constante.
La presión a la que se mide el calor específico es especialmente importante para gases y líquidos.
Unidades de calor
La unidad de medida del calor en el Sistema Internacional es el joule (J). La caloría (cal) también se usa frecuentemente en las aplicaciones científicas y tecnológicas. La caloría se define como la cantidad de calor necesario para aumentar en 1 °C la temperatura de un gramo de agua destilada, en el intervalo de 14,5 °C a 15,5 °C.[8] Es decir, tiene una definición basada en el calor específico.Unidades de calor específico
En el Sistema Internacional de Unidades, el calor específico se expresa en julios por kilogramo y por kelvin (J·kg-1·K-1); otra unidad, no perteneciente al SI, es la caloría por gramo y por kelvin (cal·g-1·K-1). Así, el calor específico del agua es aproximadamente 1 cal/(g·K) en un amplio intervalo de temperaturas, a la presión atmosférica; y exactamente 1 cal·g-1·K-1 en el intervalo de 14,5 °C a 15,5 °C (por la definición de la unidad caloría).En los Estados Unidos, y en otros pocos países donde se sigue utilizando el Sistema Anglosajón de Unidades, en aplicaciones no científicas, el calor específico se suele medir en BTU (unidad de calor) por libra (unidad de masa) y grado Fahrenheit (unidad de temperatura).
La BTU se define como la cantidad de calor que se requiere para elevar un grado Fahrenheit la temperatura de una libra de agua en condiciones atmosféricas normales.[

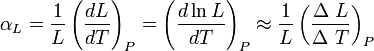 ||left}} Donde
||left}} Donde  , es el incremento de su integridad física cuando se aplica un pequeño cambio global y uniforme de temperatura
, es el incremento de su integridad física cuando se aplica un pequeño cambio global y uniforme de temperatura  a todo el cuerpo. El cambio total de longitud de la dimensión lineal que se considere, puede despejarse de la ecuación anterior:
a todo el cuerpo. El cambio total de longitud de la dimensión lineal que se considere, puede despejarse de la ecuación anterior:![L_f = L_0 [1 +\alpha_L (T_f - T_0)]\;](http://upload.wikimedia.org/math/4/d/8/4d8d9e521d59aa36de0d776706db3b16.png)


 , es decir, el coeficiente de dilatación volumétrico es numéricamente unas 3 veces el coeficiente de dilatación lineal de una barra del mismo material.
, es decir, el coeficiente de dilatación volumétrico es numéricamente unas 3 veces el coeficiente de dilatación lineal de una barra del mismo material.